1型糖尿病是由于免疫系统破坏了产生胰岛素的胰岛细胞,患者依赖胰岛素治疗。但长期胰岛素治疗仍然不能避免糖尿病并发症的发生和发展,并且胰岛素用量过高会导致低血糖发作,严重者可以威胁患者生命。
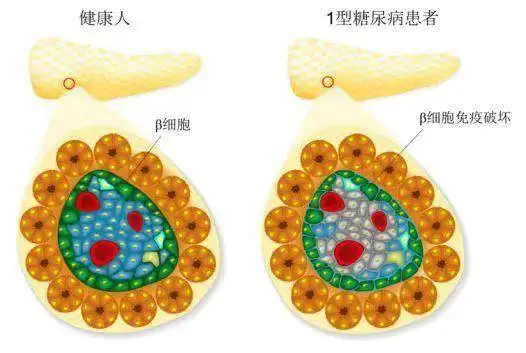
虽然目前胰岛移植可以有效治疗1型糖尿病,显著降低糖尿病严重并发症的发生和发展,但适合胰岛移植的胰腺供体严重短缺,极大限制其广泛应用。人多能干细胞具有无限增殖和分化为功能性细胞的潜能,这使其有望用于包括1型糖尿病在内的多种重大疾病的治疗。
2022年2月4日,北京大学邓宏魁研究组、中国医学科学院/北京协和医学院彭小忠研究组和天津市第一中心医院沈中阳研究组合作,在国际顶尖医学期刊《Nature Medicine》发表了题为:Human Pluripotent Stem Cell-derived Islets Ameliorate Diabetes in Nonhuman Primates 的研究论文。该研究解决了高效诱导人多能干细胞(IPS)分化成为功能成熟的胰岛细胞的难题,有望在将来成为治愈1型糖尿病更为理想的治疗方案。

01
我国科学家在干细胞治疗糖尿病研究中获得重要进展
人多能干细胞(IPS)是具有多项分化潜能的干细胞,可以在体外通过诱导分化成为功能成熟的胰岛细胞,但分化效率低下一直是阻碍其发展的重要瓶颈。邓宏魁研究组大幅改进了人多能干细胞向胰岛细胞的分化方案,重点解决了如何高效率地诱导从胰腺前体细胞向胰岛内分泌细胞命运特化的难题,从而使体外大规模制备功能成熟的胰岛细胞成为可能。

△邓宏魁教授
研究团队通过三维重构诱导前肠后部细胞形成胰岛样细胞球,并优化胰腺前体向内分泌前体细胞分化的诱导条件,最终能够在不同的供体来源的人多能干细胞株上实现稳定、高效的胰岛细胞诱导分化,获得结构和功能与人原代胰岛相似的人多能干细胞分化胰岛。
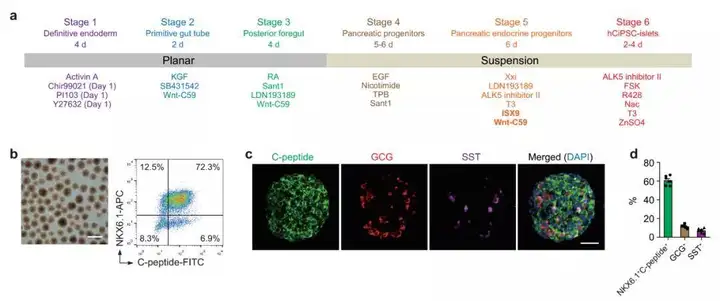
△人多能干细胞定向分化为胰岛细胞
研究团队将人多能干细胞分化胰岛移植入糖尿病模型小鼠体内,可以有效逆转糖尿病,而且在长达48周的观察周期中,所有移植小鼠中均未观察到移植细胞致瘤现象。
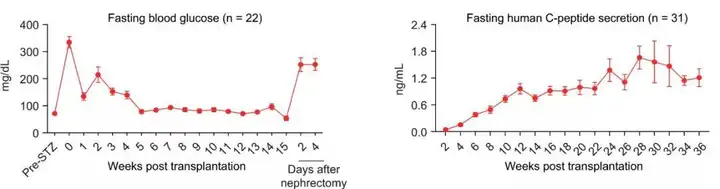
△人多能干细胞分化的胰岛细胞移植入糖尿病小鼠模型后逆转小鼠糖尿病
在此基础上,研究团队进一步将人多能干细胞分化的胰岛细胞移植入糖尿病非人灵长类模型中,观察其长期安全性和有效性。非人灵长类动物模型在遗传学、解剖学、代谢和生理学方面与人类高度相似,使其成为非常理想的模型系统。
研究团队使用临床常用的胰岛移植方案——肝门静脉移植,将人多能干细胞分化的胰岛细胞输注到糖尿病模型猴体内,受体猴的空腹血糖和平均餐前血糖显著降低。研究团队观察到,接受细胞移植的糖尿病猴的C肽(胰岛素分泌标记物)释放能够响应餐食或葡萄糖刺激。HbA1c是临床常用的指标,用于综合评价糖尿病患者的中长期的血糖控制情况;HbA1c每降低一个百分点,糖尿病相关并发症的风险就会随之显著下降。值得指出的是,在4只长期跟踪观察的糖尿病模型猴上,糖化血红蛋白(HbA1c)与移植前峰值相比,下降了2%以上。
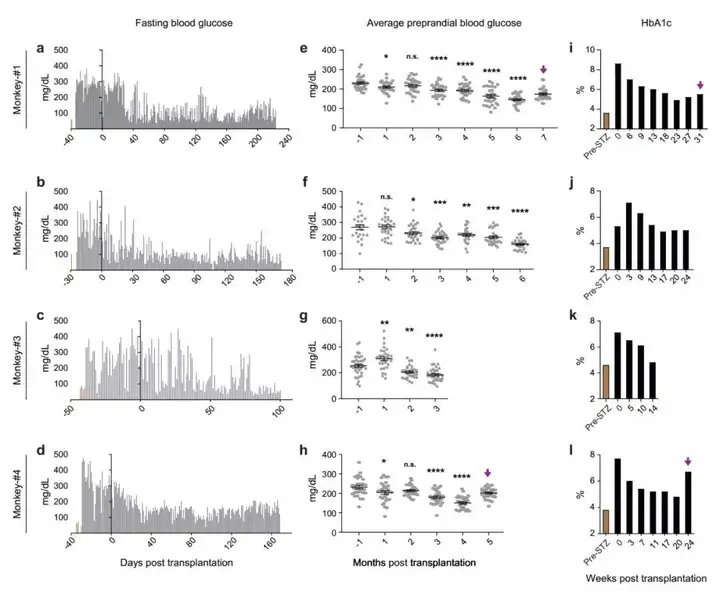
△人多能干细胞分化的胰岛细胞移植入糖尿病猴模型有效改善其血糖控制
研究人员还发现,在一只血糖波动幅度大、控制整体较差的糖尿病模型猴上,移植人多能干细胞分化的胰岛细胞后其血糖的控制得到了明显改善。这一结果提示了人多能干细胞分化的胰岛细胞移植有望用于脆性糖尿病患者的治疗,可以有效降低脆性糖尿病患者的死亡风险。
作为国际首个在非人灵长类模型上系统地评价人多能干细胞来源的胰岛细胞治疗糖尿病可行性的研究,本研究在非人灵长类动物模型上证明了人多能干细胞分化的胰岛细胞在糖尿病治疗中的安全性和有效性。
02
干细胞技术有望成为治愈1型糖尿病更为理想的治疗方案
这是我国科学家在干细胞治疗糖尿病研究领域中获得的重要进展,有望在将来成为治愈1型糖尿病更为理想的治疗方案。

与此同时,国外也开展了利用干细胞全分化的胰岛细胞治疗1型糖尿病的人体临床试验,并获得了积极的结果。
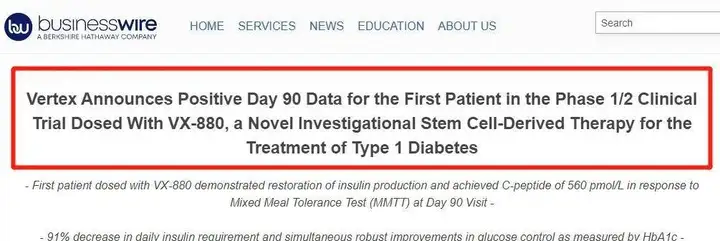
2021年10月18日,美国Vertex医药公司宣布,其干细胞的全分化胰岛细胞替代疗法在1/2期临床试验的首例1型糖尿病患者中获得积极数据:患者在接受单剂治疗90天后体内胰岛素恢复生产,并且每天胰岛素使用量减少91%。据悉,这是首次试验数据证实这一细胞疗法可显著恢复1型糖尿病患者的胰岛细胞功能。
展望未来
干细胞治疗糖尿病的临床应用时代已经来临。相信在不久的未来,随着研究的不断深入和临床技术的不断成熟,糖尿病患者可以完全摆脱严格控制饮食,餐前饭后关注血糖,担忧并发症危及生命的疾病困扰,获得更高质量和更加健康的生活方式。



